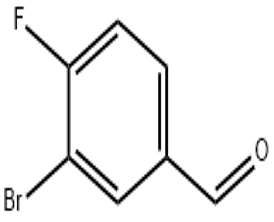
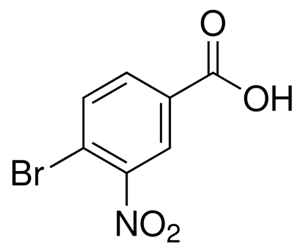
alfa-ionon (CAS#127-41-3)
| Rizikové kódy | R42/43 – Může vyvolat senzibilizaci při vdechování a při styku s kůží. |
| Popis bezpečnosti | S24/25 – Zamezte styku s kůží a očima. |
| WGK Německo | 2 |
| RTECS | EN0525000 |
| TSCA | Ano |
| Kód HS | 29142300 |
alfa-ionon (CAS#127-41-3) informace
Fialový keton, také známý jako benzofenon, je organická sloučenina. Zde jsou některé bezpečnostní informace o ionone:
1. Toxicita: Fialový keton má určitou toxicitu pro lidské tělo. Může způsobit poškození centrálního nervového systému a jater a může mít nepříznivé účinky na reprodukční systém a embrya.
2. Nebezpečí při vdechnutí: Vdechování výparů nebo prachu iononu může způsobit nepříjemné příznaky, jako jsou závratě, ospalost, kašel a potíže s dýcháním. Dlouhodobá expozice může způsobit poškození centrálního nervového systému.
3. Nebezpečí kontaktu: Fialový keton může být absorbován kůží. Dlouhodobý nebo rozsáhlý kontakt může způsobit podráždění kůže a očí. Při manipulaci s iononem je třeba používat vhodné osobní ochranné prostředky, jako jsou rukavice a bezpečnostní brýle.
4. Opatření pro hašení požáru: V případě úniku nebo požáru použijte k uhašení požáru suchý prášek, pěnu nebo oxid uhličitý. Nepoužívejte vodu, protože fialový keton reaguje s vodou za vzniku hořlavých plynů.
5. Likvidace odpadu: Odpadní fialový keton zlikvidujte řádně v souladu s místními předpisy a pravidly. Nevylévejte jej do kanalizace nebo odpadkového koše.
6. Opatření pro skladování: Fialový keton by měl být skladován na chladném, suchém a dobře větraném místě, mimo zdroje ohně a oxidantů.
Tyto informace jsou pouze orientační. Pokud je nutné další použití nebo zpracování iononu, podívejte se prosím na příslušný bezpečnostní list a poraďte se s odborníkem.
příroda
Fialový keton, také známý jako linaylketon, je přírodní ketonová sloučenina. Je hlavní složkou aroma květů fialek.
Fialový keton je bezbarvá až světle žlutá olejovitá kapalina, která je při pokojové teplotě těkavá.
Fialový keton je rozpustný v alkoholových a etherových rozpouštědlech a mírně rozpustný ve vodě. Jeho hustota je relativně nízká, s hustotou 0,87 g/cm³. Je citlivý na světlo a dokáže absorbovat ultrafialové paprsky.
Fialový keton může být oxidován na ketonalkoholy nebo kyseliny v chemických reakcích a může být redukován na alkoholy pomocí hydrogenačních redukčních reakcí. Může podstoupit alkylační a esterifikační reakce s mnoha sloučeninami.
Aplikace a metoda syntézy
Fialový keton (také známý jako fialový keton) je aromatická ketonová sloučenina. Má zvláštní vůni a často se používá v parfémovém a parfémovém průmyslu. Následuje úvod do použití a metod syntézy iononu:
Účel:
Parfém a koření: vonné vlastnosti iononu, který se široce používá v průmyslu parfémů a koření k výrobě produktů s fialovou vůní.
Metoda syntézy:
Syntéza iononu se obecně dosahuje pomocí následujících dvou metod:
Oxidace nukleobenzenu: Nukleobenzen (benzenový kruh s methylovým substituentem) je podroben oxidační reakci, jako je použití oxidační kyseliny nebo kyselého roztoku manganistanu draselného, za vzniku iononu.
Vazba pyrylbenzaldehydu: Pyrylbenzaldehyd (jako je benzaldehyd se substituenty pyridinového kruhu v poloze para nebo meta) reaguje s anhydridem kyseliny octové a dalšími reaktanty za alkalických podmínek za vzniku iononu.